
Sanofi готується до реєстрації свого препарату для уповільнення діабету 1 типу в ЄС
Комітет з лікарських засобів для людини (CHMP) рекомендував схвалити препарат Teizeild для лікування пацієнтів віком від восьми років з цукровим діабетом 1-го типу, щоб уповільнити прогресування захворювання до третьої стадії (клінічного діабету).

- Автор: Анастасія Цвігун, редакторка
- access_time
При цукровому діабеті 1-го типу (ЦД1) імунна система людини помилково атакує і руйнує β-клітини підшлункової залози, які виробляють інсулін. Це означає, що організм не може регулювати рівень глюкози (цукру) в крові. Люди з ЦД1 повинні самостійно вводити собі інсулін за щоденних допомогою ін'єкцій чи інсулінової помпи. [Попри значний прогрес медицини та численні наукові розробки, інсулінотерапія залишається ключовим методом лікування ЦД1].
Близько 8,4 млн. людей у всьому світі живуть з цукровим діабетом 1-го типу, з яких 2,2 млн. — у Європі. За прогнозами до 2040 року діагноз ЦД1 буде поставлений від 13,5 до 17,4 млн. людей у всьому світі.
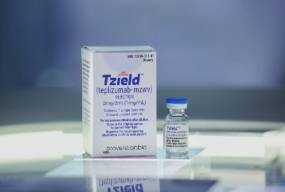
Teizeild (теплізумаб) — імунотерапія, призначена для затримки розвитку цукрового діабету 1-го типу. Його дія спрямована на зниження швидкості руйнування бета-клітин підшлункової залози, через втрату яких і прогресує хвороба. Препарат вводиться внутрішньовенно один раз на добу протягом двох тижнів поспіль.
Спершу теплізумаб був розроблений компанією Provention Bio. У 2023 році компанія Sanofi придбала Provention Bio, отримавши повні права на препарат і можливість його глобального просування. Це дозволило пришвидшити вихід теплізумабу на нові ринки та розширити доступ пацієнтів до інноваційного лікування.
Схвальне рішення CHMP означає, що реєстрація препарату в Європейському Союзі має завершитися у найближчі тижні, після чого Teizeild стане першим терапевтичним засобом для лікування діабету 1-го типу у ЄС, який змінює перебіг захворювання.
Препарат був рекомендований на основі результатів дослідження TN-10, у ході якого теплізумаб уповільнив перехід до третьої стадії* діабету в середньому на два роки порівняно з пацієнтами, які отримували плацебо. Крім того, пацієнти, які лікувалися Teizeild, мали значно вищі показники стимульованого С-пептиду на 78-му тижні спостереження. Клінічно значущий рівень С-пептиду 0,2 пмоль/мл і вище зберігався у 94,9% учасників групи теплізумабу, порівняно з 79,2% у групі плацебо.
*Що означає третя стадія ЦД1?
Існують різні стадії розвитку цукрового діабету 1-го типу. На 1-ій стадії рівень цукру в крові нормальний, але в крові починають з'являтися аутоантитіла — маркери активності захворювання — до бета-клітин, які виробляють інсулін, що створює передумови для їхнього знищення і переходу до 2-ої та 3-ої стадій. На 2-й стадії ЦД1 атака на бета-клітини прогресує, але рівень цукру в крові все ще залишається у нормі, якщо тільки певний тест, наприклад, тест на толерантність до глюкози, не виявить порушення реакції бета-клітин. Ризик розвитку 3-ої стадії, або клінічного діабету, протягом двох років становить близько 50%. Більшість пацієнтів приходять до лікаря або потрапляють у відділення невідкладної допомоги з діабетом 1-го типу на 3-ій стадії, коли вже наявні класичні симптоми захворювання, зокрема діабетичний кетоацидоз (ДКА).
Американський фармрегулятор FDA схвалив теплізумаб у 2022 році для затримки прогресування клінічного діабету 1-го типу у пацієнтів віком від восьми років, які перебувають на доклінічній стадії. У США препарат продається під торговою назвою Tzield.
Також теплізумаб нещодавно отримав дозволи у Китаї та Великій Британії.
***Джерело: thePharmaMedia
Читайте також:
Препарат Teplizumab зберігає функцію бета-клітин у дітей з ЦД1: результати нового дослідження
Нобелівська премія з медицини 2025: відкриття, що може змінити підхід до автоімунних хвороб

Діабетична аптечка (онлайн версія) від 6 жовтня 2025
Читати номер











Ви не авторизовані